
EL AJOLOTE PARECE una pieza de ciencia ficción. Esta salamandra mexicana, de aspecto eternamente juvenil, posee un superpoder que desafía la biología tal como la conocemos: la capacidad de regenerar extremidades enteras, partes de su corazón e incluso su médula espinal.
Pero, ¿cómo sabe una extremidad amputada si debe regenerar un brazo completo desde el hombro hacia abajo o solo una mano desde la muñeca?
Este misterio de la «identidad posicional» ha fascinado a los científicos durante décadas.
Un equipo de la Universidad Northeastern, dirigido por James Monaghan, ha desentrañado una pieza clave de este rompecabezas biológico.
En un estudio publicado en Nature Communications, los investigadores revelan un elegante mecanismo molecular que actúa como un sistema de coordenadas GPS para regenerar células. Sorprendentemente, el secreto no reside en producir una señal química mayor, sino en la rapidez con la que se destruye.
Los estudios científicos
El laboratorio de Monaghan alberga alrededor de 500 ajolotes, cuidados por un equipo que incluye desde estudiantes universitarios hasta posdoctorados.
“Criar ajolotes implica gestionar un sistema acuático complejo y ser paciente, ya que alcanzan la madurez sexual en un año. Es un proceso más lento que con otros organismos modelo, pero también más emocionante. En muchos experimentos, el equipo está explorando terrenos completamente nuevos”, afirma Monaghan.

Durante más de dos décadas, el laboratorio de Monaghan ha estudiado el ajolote para comprender cómo regenera órganos complejos como las extremidades, la médula espinal, el corazón y la cola.
La investigación de su laboratorio se centra en descubrir por qué los nervios son esenciales para este proceso y qué propiedades celulares únicas permiten a los ajolotes regenerar tejidos que otros animales no pueden.
Estos hallazgos podrían transformar nuestra comprensión de la regeneración corporal y tener importantes aplicaciones en la medicina regenerativa.
“Durante años hemos sabido que el ácido retinoico, un derivado de la vitamina A, es una molécula crucial que les dice a las células: «¡Construyan un hombro!»”, explica Monaghan. Pero el enigma residía en cómo las células del muñón de la extremidad en regeneración controlaban sus niveles con tanta precisión como para saber exactamente dónde se encontraban en el eje del hombro a la mano.
Un largo camino
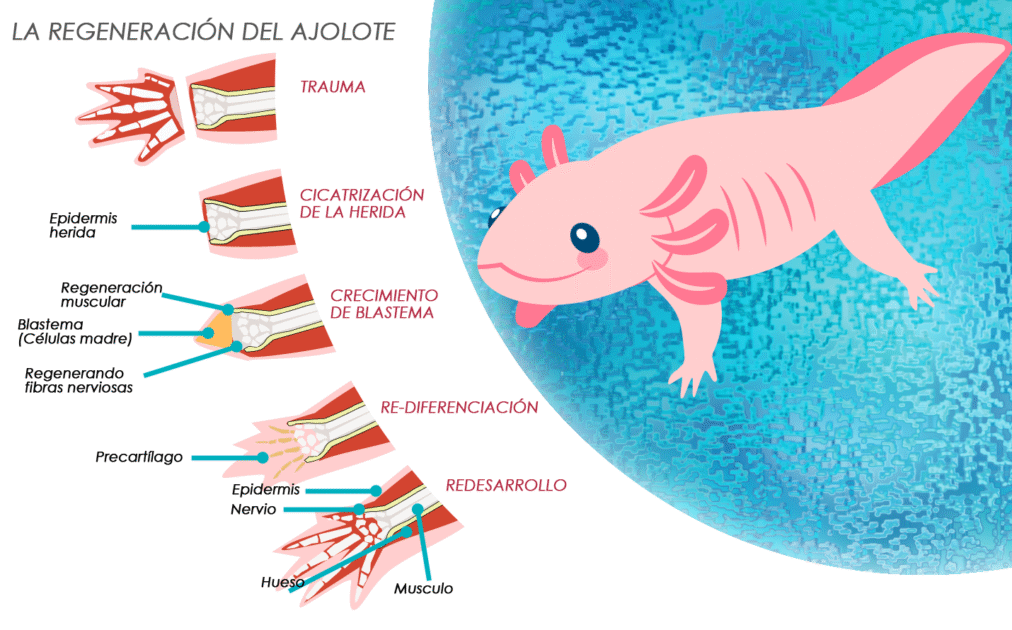
Para desentrañar este misterio, el equipo se centró en un grupo de células madre que se forman en la herida tras la pérdida de una extremidad en animales como el ajolote, que son capaces de regenerarse.
Conocido como blastema, es esta base de células madre la que orquesta la regeneración. La teoría predominante era que las diferencias en la producción de ácido retinoico podrían explicar por qué una amputación de hombro (proximal) provoca la regeneración de toda la extremidad, mientras que una amputación de muñeca (distal) solo regenera la mano.
«Nuestra gran sorpresa fue descubrir que la clave no residía en la cantidad de ácido retinoico producido, sino en cómo se degradaba», afirma Monaghan.
El equipo descubrió que las células de la parte distal de la extremidad, la muñeca, están repletas de una enzima llamada CYP26B1, cuya única función es destruir el ácido retinoico.
En contraste, las células del hombro apenas poseen esta enzima, lo que permite que el ácido retinoico se acumule en niveles elevados.
Esta diferencia crea un gradiente químico a lo largo de la extremidad: mucho ácido retinoico en el hombro, poco en la muñeca. Es este gradiente el que informa a las células de su ubicación exacta.
En los humanos, esta vía de plasticidad celular está ausente o cerrada. «Por lo tanto, el gran desafío es comprender cómo inducir este estado blastemal en nuestras células, una estructura transitoria clave en la regeneración.
De lograrse, nuestras células podrían responder de nuevo a señales posicionales y regenerativas, como lo hacen en el ajolote», explica el investigador.

Engañando a las células para que se sobrerregeneren
Para confirmar su descubrimiento, los investigadores realizaron un experimento.
Amputaron las patas del ajolote a la altura de la muñeca y administraron un fármaco llamado talarozol, que inhibe la enzima CYP26B1.
Al «desactivar los frenos», el ácido retinoico se acumuló en niveles extremadamente altos en un lugar donde normalmente no debería.
Como resultado, las células de la muñeca, «confundidas» por la alta concentración de ácido retinoico, interpretaron la posición como si fuera el hombro.
En lugar de regenerar una mano, procedieron a regenerar una extremidad completa y duplicada. «Fue la prueba definitiva», afirma Monaghan.
“El ajolote posee propiedades celulares que queremos comprender a fondo”, afirma Monaghan.
“Si bien la regeneración de una extremidad humana completa aún es ciencia ficción, cada vez que descubrimos un fragmento de su mapa genético, como la función de CYP26B1 y Shox, nos acercamos un paso más a comprender cómo orquestar la reparación tisular compleja en humanos”.
Para acercar esta ciencia a las aplicaciones clínicas, un paso crucial es lograr inducir la formación de blastema de células madre en sitios de amputación en humanos.
“Este es el ‘santo grial’ de la biología regenerativa. Comprender los componentes mínimos que lo conforman —las señales moleculares, el entorno celular, las condiciones fisiológicas— nos permitiría transformar una cicatriz en tejido regenerativo”, explica Monaghan.
En su investigación actual, aún quedan lagunas por resolver: cómo se regula el gradiente de CYP26B1, cómo se conecta el ácido retinoico al gen Shox y qué factores posteriores determinan la formación de estructuras específicas, como el húmero o el radio.
De la curación a la regeneración
Monaghan explica que los ajolotes no poseen un «gen mágico» para la regeneración, sino que comparten los mismos genes fundamentales que los humanos.
«La diferencia clave radica en la accesibilidad a esos genes. Mientras que una lesión en humanos activa genes que inducen la cicatrización, en las salamandras se produce una desdiferenciación celular: las células regresan a un estado similar al embrionario, donde pueden responder a señales como el ácido retinoico.
Esta capacidad de regresar a un «estado de desarrollo» es la base de su regeneración», explica el investigador.
Entonces, si los humanos tenemos los mismos genes, ¿por qué no podemos regenerarnos?
«La diferencia radica en que la salamandra puede acceder a ese programa [de desarrollo] después de una lesión». Los humanos no pueden; solo acceden a esta vía de desarrollo durante el crecimiento inicial, antes del nacimiento.
«Hemos tenido una presión selectiva para desactivar y sanar», dice Monaghan. «Mi sueño, y el sueño de la comunidad, es comprender cómo hacer la transición de la cicatriz al blastema».
Monaghan afirma que, en teoría, no sería necesario modificar el ADN humano para inducir la regeneración, sino intervenir en el momento y lugar adecuados en el cuerpo con moléculas reguladoras.
Por ejemplo, las vías moleculares que indican a una célula que se ubique en el codo, en el lado del meñique, y no en el pulgar, podrían reactivarse en un entorno regenerativo utilizando tecnologías como Crispr.
«Este conocimiento podría aplicarse en terapias con células madre. Actualmente, las células madre cultivadas en laboratorio no saben ‘dónde están’ cuando se trasplantan.
Si se pueden programar con señales posicionales precisas, podrían integrarse correctamente en los tejidos dañados y contribuir a la regeneración estructural, como la formación de un húmero completo», afirma el investigador.
Conclusiones sobre los estudios científicos
Tras años de trabajo, comprender la función del ácido retinoico —estudiado desde 1981— es motivo de profunda satisfacción para Monaghan.
El científico imagina un futuro en el que un parche aplicado sobre una herida pueda reactivar los programas de desarrollo de las células humanas, emulando el mecanismo regenerativo de la salamandra.
Aunque no es inmediato, cree que la ingeniería celular para inducir la regeneración es un objetivo ya al alcance de la ciencia.
Reflexiona sobre cómo el ajolote ha tenido una segunda vida científica. «Fue un modelo dominante hace cien años, luego cayó en desuso durante décadas y ahora ha resurgido gracias a herramientas modernas como la edición genética y el análisis celular.
El equipo puede estudiar cualquier gen y célula durante el proceso regenerativo. Además, el ajolote se ha convertido en un icono cultural de ternura y rareza».
Fuente: Wired


Más historias Imperivm
Descubren la estrategia de Grupo Salinas para postergar el pago de impuestos:
CANDIDATAS Y CANDIDATOS AL PODER JUDICIAL MÉXICO
MAYITO FLACO LLEGA A PELEAR CULIACÁN A LOS CHAPITOS